

您的当前位置:博库网首页 > 电子书专题 > 学习贯彻习近平新时代中国特色社会主义思想 打赢新冠肺炎疫情防控人民战争总体战阻击战案例 > 第28章
案例分析
中国特色社会主义制度和国家治理体系具有显著优势。我们所说的国家治理现代化,区别于西方倡导的治理(governance)或善治(good governance)理论,是具有基础性、整体性、战略性的制度设计和执行,是有中心的主动作为和多维互动。
本案例依照“目标—结构—任务”的一般逻辑,将新冠疫苗研发置于国家治理现代化的视角下,以保障和促进公众健康为逻辑起点,进而与医药产业经济高质量发展、保障基本民生、防范化解重大风险构建起关联。“一核多元”的治理结构以党的坚强统一领导为中心,同时纳入人民健康、政府治理、产业发展、科技创新等制度要素,形成坚定一致的政策目标。战略任务包括科学监管和社会共治,其分别聚焦政府和市场、国家和社会两大关系,特别是基于政府与产业长期互动构建的良性关系,最终实现新冠疫苗高效有序、又快又好的研发目标。
作为用于健康人的特殊产品,疫苗安全有效的要求是第一位的。截至2019年,我国有45家疫苗生产企业,可生产预防34种疾病的60种以上疫苗,安全标准整体与欧盟接轨。我国曾在2011年和2014年两次通过世界卫生组织“疫苗国家监管体系”(NRA)评估,颁布施行了全球第一部综合性疫苗管理法,是世界上为数不多的能够依靠自身力量解决全部免疫规划疫苗的国家之一。
根据世界卫生组织统计,截至2020年11月12日,全球范围内已有212项新冠肺炎疫苗研究启动,在11项进入临床Ⅲ期的试验中,中国占据5项,在全球居于领先地位。美国、英国和德国也各有疫苗项目获批开展Ⅲ期临床试验。在经过确认的处于活跃研发状态的候选疫苗(vaccine candidate)中,约70%由私营部门开发,其余30%由学术机构、公共部门和非营利组织牵头开发。在大型跨国制药企业中,强生、赛诺菲·巴斯德、辉瑞和葛兰素史克已开展新冠疫苗研发工作,但这些领先企业大多被认为产能不足或缺乏大规模生产经验。因此,单纯的市场力量难以在重大突发公共卫生事件中有效解决疫苗研发和供给问题,新冠疫苗应被列为“全球公共产品”,并从战略高度整体谋划和协同推进疫苗研发。
疫苗研发是一个长期、耗资巨大且充满未知的过程,有极高失败风险。在常态下,人们遵循“临床前研究—临床Ⅰ、Ⅱ、Ⅲ期试验—上市许可—大规模量产”的线性步骤开发疫苗,其间还会有多次停顿,从疫苗开始研发到产品最终进入国际市场一般需要5—18年。全球大流行情境中的疫苗开发则有着全新范式(图1),不仅需要迅速启动临床前研究,还必须在某些特定步骤成功之前平行开展后续步骤,通俗而言是“串联”改“并联”,通过阶段重叠将疫苗开发时间压缩到12—18个月。
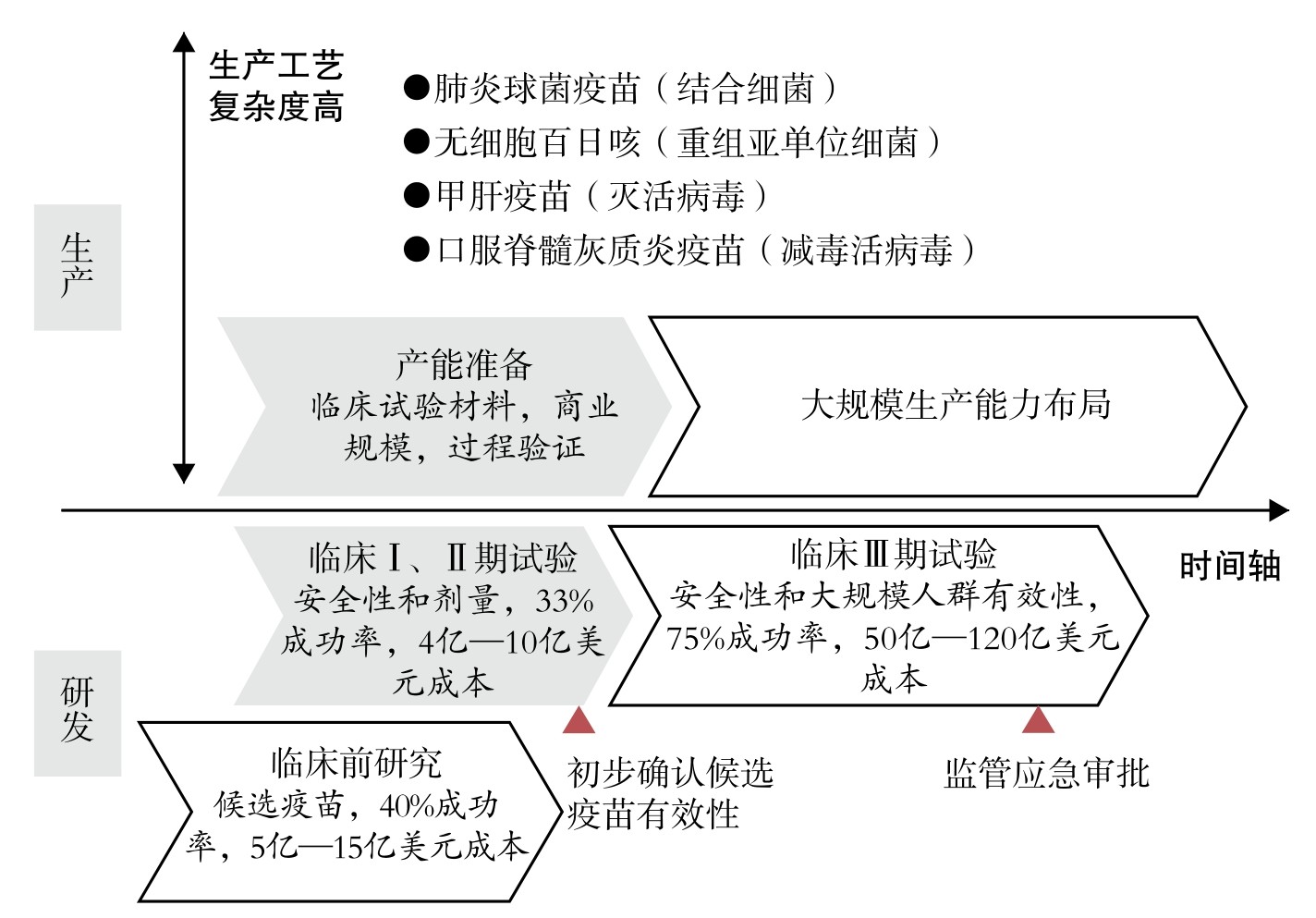
图1 全球大流行情境中疫苗研发和生产范式创新
资料来源:(1)生产工艺复杂度数据来自Paul Wilson. Giving developing countries the best shot:An overview of vaccine access and R&D. Geneva:Campaign for Access to Essential Medicines, April 2010; (2)各阶段成功率和成本数据来自FE André. How the research-based industry approaches vaccine development and establishes priorities. Developments in Biologicals, January 2002,110; (3)经作者整理。
大流行疫苗开发范式的目标,是找到一个或多个安全有效的疫苗。首先,临床前研究的目的是确定生物靶点和开发合作伙伴,并根据动物实验结果等数据决定是否继续投资候选疫苗。其次,临床试验与产能准备工作同步开展,原本在临床Ⅱ期试验结束后才进行的商业化生产过程验证也有所提前。考虑到不同类型疫苗生产工艺的复杂程度差异,产能准备提前量亦有所不同,因此产能准备的时间节点需要更加提前。再次,研发者、生产企业和监管部门需要在不同阶段加强交流,并充分考虑疫苗开发成功率和产能地理分布等因素,在临床Ⅲ期试验过程中就开展大规模生产能力布局。最后,监管部门以应急审批实现疫苗上市的紧急授权,从而尽早保障民众对疫苗产品的可及性。
随着此次疫情蔓延,人们已经开始意识到上述范式转变的重要性。如由12位美国顶级科学家发起的一项疫情应对行动(Scientists to stop COVID-19)被喻为“新冠曼哈顿计划”,其致力于优化疫苗开发进程。具体包括制定疫苗研发临床评估的标准化方法并得到监管部门支持,从而对数据进行快速而有意义的横向比较。同时以前所未有的透明度和端到端方式(end-to-end)协调利益相关者,在获得大量临床数据之前,对任何有潜力的候选疫苗做出重大开发决策,并权衡产品安全与生产成本的风险获益,适当削减生产法规要求以及针对疫苗的特定要求。
公共卫生事务,是通过社会、机构、公共和民营、社区、个人的知情选择以及组织化行动,来预防疾病、延长生命和促进健康的科学和艺术。自20世纪90年代后期以来,一些国家开始倡导用跨界协同(cross-sector collaboration)解决传染病、食品安全、社区健康等公共卫生难题。其特征是在承认行政主导的基础上,通过正式且清晰的制度安排,引导企业、社会组织、专家、公众等多元主体参与,提高公共卫生决策和服务供给的效能。疫苗开发涉及跨部门、跨层级、跨领域的主体和行为,是风险社会情境下典型的“棘手问题”(wicked problems);与此同时,大流行又放大了疫苗市场机制失灵,需要引入多方参与的协同治理机制加以弥补。基于上述理论和政策实践,给定宏观系统情境和驱动因素不变,研究构建“动力—行动—结果”的疫苗研发协同治理机制分析框架(图2),阐述将中国特色社会主义制度优势转化为快速研发效能的机理。
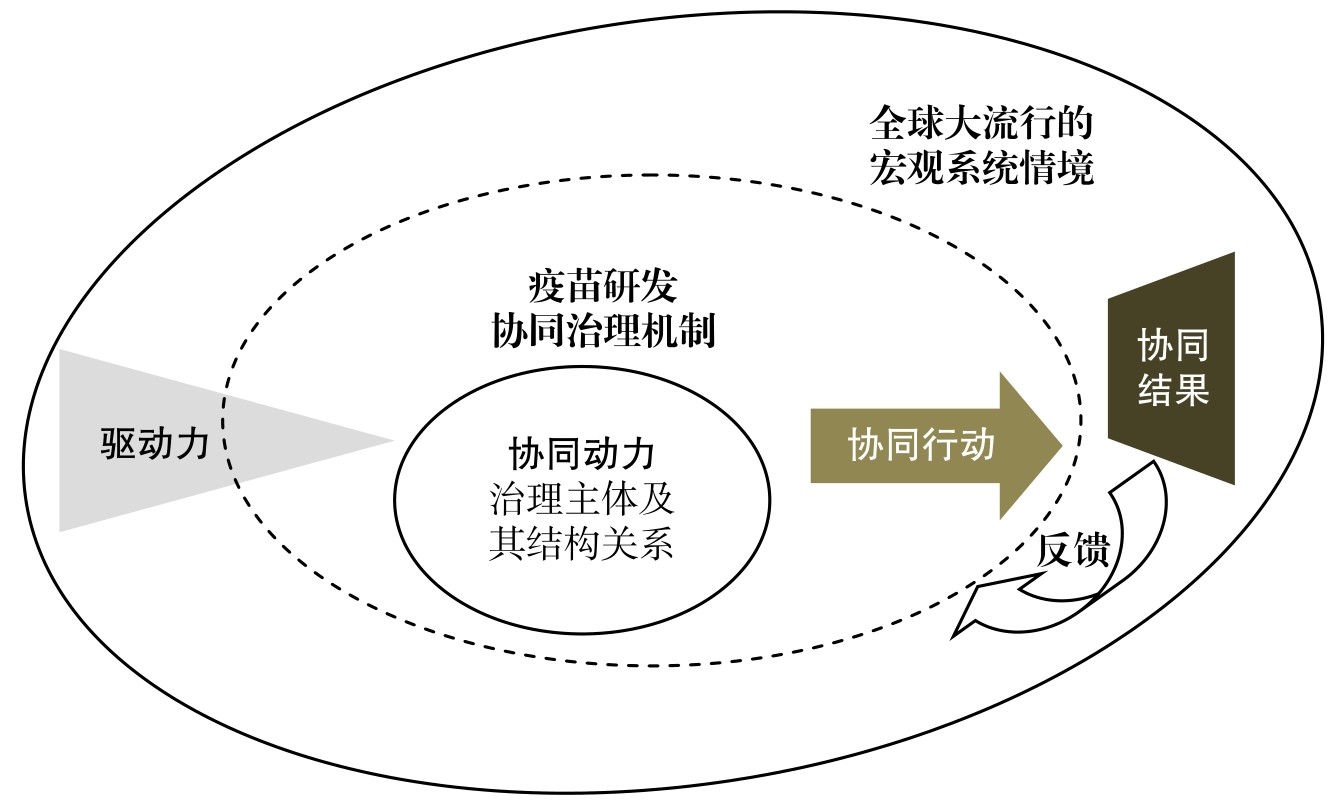
图2 疫苗研发协同治理机制框架
资料来源:(1)Emerson, Kirk. Collaborative Governance of Public Health in Low-and Middle-income Countries:Lessons from Research in Public Administration. BMJ Global Health,2018(3); (2)经作者整理。
新型举国体制体现在新冠疫苗研发中,是以国家公共卫生安全和人民健康为政策目标,科学统筹、集中力量、优化制度、协同公关,以科研攻关组聚焦疫情防控的战略制高点,实现高质量发展和高效能治理的制度安排。第一,协同动力是治理主体及其结构关系,也就是各主体形成的制度依存和权责划分,从而提供了协同治理的启动机制。制度相互依存度高,可以有效化解冲突和不信任,防止治理主体中途退出协同。疫苗研发涉及产业管理部门、药品监管部门、疾病预防控制机构、创新型制药企业以及公共卫生领域专业社会组织,其拥有不同目标函数和比较优势。特别是全球大流行要求研发者和生产企业在候选疫苗安全性和有效性未知的前提下,必须有可信的政策承诺加以保障,方能激励协同动力。第二,中国语境下的协同行动是在党的领导下,治理主体基于参与规则、沟通理解、互信承诺开展的决策、管理和执行活动,通过构建正当性形成协同治理的提升机制。2020年2月23日,习近平总书记在统筹推进新冠肺炎疫情防控和经济社会发展工作部署会议上强调,“加大药品和疫苗研发力度,同临床、防控实践相结合,注重调动科研院所、高校、企业等的积极性”。因此,需要将赋能政府嵌入协同网络结构中,在此基础上发挥多元主体的共治作用,直接参与并助推科学决策、高效管理和客观评估,从而持续互动,应对疫苗研发所伴随的各类不确定性。第三,协同结果是经过影响、调适等步骤产出的效能,也就是协同治理的反馈机制。其往往取决于网络如何被结构化组合,以及协同过程如何被管理。本案例提出的基本观点是:当主体及其结构所内含的自我增强和互动属性越强,协同过程中理念一致而且能力匹配时,疫苗研发的协同结果就越好。
归纳而言,协同治理对疫苗研发实践的启示集中在网络结构(network structure)和管理策略(managerial strategy)两方面。高效成熟的网络结构使信息、资源在不同组织和项目之间顺畅流动。疫苗研发协同治理的网络结构聚焦两个命题:多元参与者如何被组织起来和管理,以及相互关系如何形成和演变。因此鉴于组织类型对协同的影响,运作良好的、民主的、有共识的组织更容易取得成功。同时,协同治理的过程和行动既发生在纵向政府层级间,也可以在横向公共部门与私人组织之间,因此同时适应科层和网络的管理策略尤为重要。
第一,构建疫苗研发的高层次协同平台。建议在未来将疫苗研发置于政策优先级,依托已有的疫苗管理部际联席会议,组建高层次的“疫苗研发工作机制”,国家发展改革委、科学技术部、工业和信息化部、财政部、国家卫生健康委、国家市场监管总局、国家药品监管局等机构参与其中,从而构建起疫苗研发的协同组织平台。“疫苗研发工作机制”职能包括:研究制定国家疫苗研发制度,协调疫苗研发体系中政府各部门职能,提出重要政策和重大项目,推动疫苗研发国际合作。例如,在2009年甲型流感疫苗接种的种类、剂量和次数等关键技术问题上,先由卫生、发展改革、工信、药监等部门进行会商,专家委员会疫苗专家指导组提供有力支持,再由联防联控工作机制上报国务院进行最终决策,而不是直接由并不掌握相关专业知识的决策者定夺。这改变了传统的协调机制和线性的决策过程,以畅通的信息与及时的会议实现扁平化的政策协调,提升决策效率。
第二,推动实施疫苗科学监管。针对疫苗全生命周期风险,改变常态“串联”路径,通过科学、严格的监管和优化、协同的程序,高效“并联”研发、生产、批签发和不良反应监测等职能。在疫苗研发方面,假若患者存量很少,在确保数据安全的基础上,国家应鼓励企业开展国际多中心临床试验。监管部门加强与世界卫生组织协调技术指导原则,并建立专供出口用疫苗的监管路径。在生产方面,制定紧急状态下疫苗研发和生产衔接的技术要求,适当调整现有法规适用条件,在保障疫苗安全的前提下支持技术转让、原液转移和分灌装质量验证,从而在有限时间内最大限度共享产能基础设施。在不良反应监测方面,国家卫生健康委和国家药品监管局应充分估计疫苗诱发疾病加重(ADE)理论风险值,尽快升级预防接种异常反应监测体系。加强临床试验和上市后不良反应监测,提升后续公众沟通、风险监测、应急处置主动性,为国产疫苗奠定坚实的质量安全基础。
第三,完善疫苗产能储备激励机制。必须充分考虑到个别国家对我国优势研发路线的封堵和孤立的可能性,将成本和投入作为非重要政策考虑因素,尽可能多布局和投资研发路线,弥补市场机制失灵。同时,政府应协调各技术路线的研发者不签署知识产权排他性协议,同时统筹产业化布局和产能扩增,从而实现低价技术转让。国家通过荣誉激励、经济激励多措并举的方式,从中央应急专项、地方政府、资本市场、国际组织等渠道多方筹措资金和分担风险,鼓励企业扩大产能,强化短缺疫苗常态监测预警,建立中央和地方两级常态短缺疫苗储备制度。
第四,积极开展疫苗研发国际合作,助力全球疫情防控。当疾病大流行时,研发能力、产能约束和囤积行为可能限制某些疫苗的全球供应。习近平总书记在《团结合作是国际社会战胜疫情最有力武器》一文有9次提到“疫苗”,强调主动同有关国家和国际组织开展研发合作。因此,为全球战“疫”提供安全有效的疫苗产品,是中国担当的重要体现。
注释:
[1]本案例正文由科技日报社记者张佳星撰写,案例分析由中央党校(国家行政学院)社会和生态文明教研部教授胡颖廉撰写,得到科学技术部的指导。